Le système immunitaire
1. INTRODUCTION
1.2. Le système immunitaire inné
1.2.1 Introduction
Le système immunitaire inné reconnaît, grâce à ces différents récepteurs PPRs (Pattern Recognition Receptors; Figure 4), des structures moléculaires spécifiques portées par des agents infectieux, regroupés sous l’entité MAMP (Microbe Associated Molecular Patterns) ou produites par des tissus lésés regroupés sous l’appellation DAMP (Damage Associated Molecular Patterns). L’activation du système immunitaire inné par ces structures moléculaires se caractérise par une réponse locale, rapide et peu spécifique qui lui permet ainsi de combattre un large panel d’agents pathogènes. Dans le système immunitaire inné il n’y a pas de processus d’apprentissage : l’amplitude de la réponse est identique à chaque nouvelle rencontre de l’agent pathogène.
Le système immunitaire inné est constitué de cellules et de messagers solubles. Il contribue pour une large part à l’initiation de la réaction inflammatoire aiguë qui constitue la toute première réponse se déroulant dans le tissu, suite à la détection de signaux de dangers ou pathogéniques par les cellules résidentes également appelées cellules sentinelles.
1.2.2 Les acteurs cellulaires
Toutes les cellules du système immunitaire inné sont issues de la moelle osseuse et dérivent soit d’un précurseur myéloïde commun soit d’un précurseur lymphoïde commun, provenant tous deux de la différenciation des cellules souches hématopoïétiques CD34+ (Figure 2). La majorité provient de la lignée myéloïde (Figures 2 et 5) :
- les polynucléaires : neutrophiles, basophiles et éosinophiles
- les phagocytes mononucléés : les monocytes/macrophages et les cellules dendritiques
- les mastocytes
D’autres sont d’origines lymphoïdes avec la particularité d’exprimer un récepteur TCR (Figures 13, 14 et 15) non conventionnel. Ces lymphocytes sont regroupés sous l’appellation : lymphocytes T non conventionnels.
Toutes ces cellules migrent de la moelle osseuse vers le sang périphérique. Certaines d’entre elles quitteront les vaisseaux sanguins pour résider dans les tissus, c’est par exemple le cas des cellules dendritiques, des mastocytes et des monocytes. Ces derniers se transforment en macrophages dans les tissus.

Figure
4 : Structure moléculaire détectée
par le système immunitaire : MAMP
et DAMP

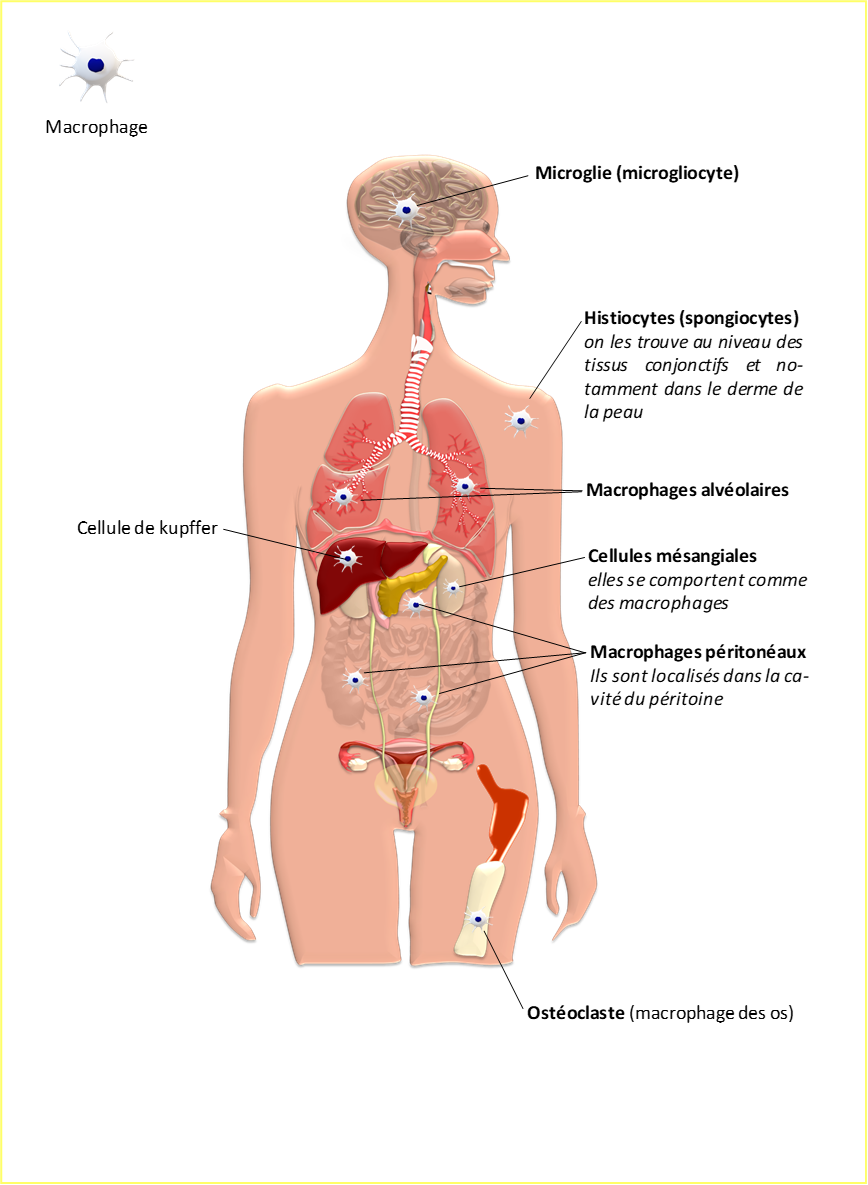
Figure 6 : Nomenclature associée aux macrophages en fonction des tissus colonisés

Figure 7 : Cytokines du système immunitaire inné
Lors de réactions inflammatoires aiguës ou chroniques, les polynucléaires et ou les monocytes colonisent les tissus lésés.
Chaque cellule du système immunitaire inné possède des propriétés et des fonctions bien définies (Figure 5).
1.2.3 Les acteurs protéiques
1.2.3.1 Les cytokines de l’inflammation
Les cellules du système immunitaire inné interagissent entre elles et avec le milieu environnant au travers de cytokines (du grec « cyto », cellule et « kinos », mouvement) qu’elles sécrètent (Figure 7). Contrairement aux hormones, les cytokines exercent leur fonction majoritairement dans un environnement local. Elles sont sécrétées suite à un stimulus externe (ex : détection d’un corps étrangers) puis elles se fixent à leur cellule cible par l’intermédiaire d’un récepteur membranaire. Elles permettent ainsi de réguler la réponse immunitaire. En fonction de leur rôle, on distingue plusieurs types de cytokines (Figure 7).
1.2.3.2 Les protéines du complément
Le complément est un élément central de l’immunité inné. Il constitue la première ligne de défense contre les agents pathogènes. Le complément agit dans l’ensemble de l’organisme au niveau des tissus, des vaisseaux sanguins et lymphatiques et à l’intérieur des cellules. Il peut être déclenchée par 3 voies différentes, la voie classique, la voie des lectines et la voie alternative (Fiche 1 et ses commentaires, p152). Le complément est formé d’une cinquantaine de protéines plasmatiques qui sont soit en phase liquide soit associées aux membranaires des cellules cibles. Les protéines du complément sont impliquées dans la détection des agents pathogènes et leur destruction (Fiches 2 et 3 et ses commentaires, p153) soit directement (complexe d’attaque membranaire) ou indirectement (induction de l’opsonisation, de l’inflammation et de l’activation du système immunitaire adaptatif).
1.2.4 Le système immunitaire inné dans l’inflammation aigüe
Le terme général d’inflammation a été affiné et remplacé par l’inflammation aiguë qui correspond à une inflammation contrôlée, adaptée, permettant à l’organisme de combattre les corps étrangers et réparer les tissus ; versus l’inflammation chronique qui est une inflammation incontrôlée et agressive conduisant à des situations pathologiques.
La réaction inflammatoire aiguë comporte 3 phases principales : la phase d’initiation, la phase d’amplification et la phase de réparation.
Dans le chapitre suivant nous traiterons ces différentes phases dans le contexte d’une infection bactérienne se déroulant au niveau d’une muqueuse.
1.2.5 La phase d’initiation de l’inflammation aigüe
Elle débute (Figure 8) par l’apparition de signaux pathogéniques (MAMP) et de signaux de dangers (DAMP) captés par les cellules résidentes que sont les macrophages, les cellules dendritiques, les mastocytes et / ou par le système du complément (Fiches 4 et ses commentaires : Pour en savoir +, p153). Ces signaux peuvent également être détectés par les cellules épithéliales, endothéliales et les plaquettes. Il en résulte une activation des cellules résidentes qui se traduit par :- la sécrétion de cytokines responsables
du recrutement des cellules du système immunitaire inné (neutrophiles, puis
macrophages)
- la vasodilatation des vaisseaux sanguins
- l’activation du système du complément
Figure 8 : L’inflammation aigüe : la phase d’initiation. Des lésions tissulaires créées par les bactéries au niveau de la muqueuse respiratoire ①, génèrent des signaux activateurs ②. Ces signaux activent les cellules résidentes (macrophages, mastocytes, cellules dendritiques ③ qui produisent et sécrètent des cytokines ④, induisant le recrutement cellulaire ⑤ et la vasodilatation des vaisseaux sanguins ⑥.
1.2.6 La phase d’amplification de l’inflammation aigüe
Les neutrophiles sont les premières cellules du système immunitaire inné à être recrutées au niveau du tissu lésé pour détruire les corps étrangers, ici en l’occurrence les bactéries (Fiches 5 et ses commentaires : Pour en savoir +, p153). Sont ensuite recrutés les cellules dendritiques et les monocytes circulants qui se transforment en macrophages lors de leur passage dans les tissus lésés. Dès leur arrivée au sein des tissus lésés, les neutrophiles, les cellules dendritiques et les macrophages sont activés soit par les cytokines produites par les cellules résidentes soit par interaction direct avec les bactéries soit par les protéines du système du complément. Les neutrophiles, macrophages et cellules dendritiques procèdent ensuite à l’élimination des bactéries par différents mécanismes : l’opsonisation, la phagocytose, la dégranulation, l’explosion oxydative, et la nétose (Fiches 5 et ses commentaires, p153). Le système du complément contribue à la mise en place de ces différents mécanismes et, de plus, il est directement responsable de la formation du complexe d’attaque (Fiches 2 et ses commentaires, p153) qui constitue un mécanisme supplémentaire pour la destruction des corps étrangers.
Dans le même temps, les cellules dendritiques immatures ayant capturés les corps étrangers migrent en direction des ganglions lymphatiques et présentent les déterminants antigéniques issus des antigènes capturés aux lymphocytes T et B.
Si les corps étrangers sont éliminés, la production et la sécrétion de cytokines par les cellules de l’immunité innée cessent, marquant l’arrêt de la réponse inflammatoire et le début de la phase de réparation tissulaire. Ce moment clef de la réaction inflammatoire correspond à la résolution de l’inflammation.
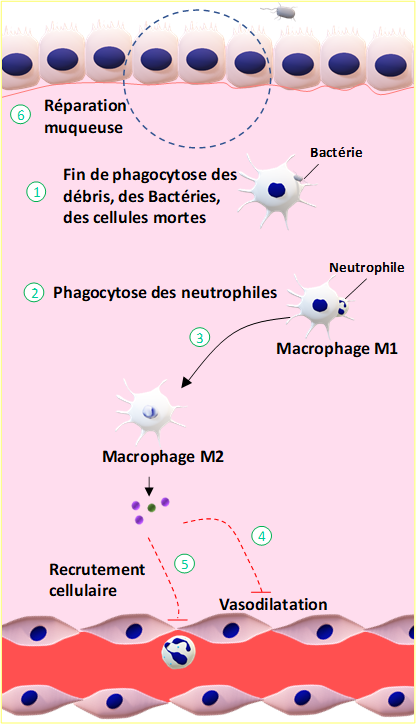
1.2.7 La phase de réparation tissulaire de l’inflammation aigüe
Après élimination des agents pathogènes (Figure 9), des débris cellulaires et des cellules mortes par les cellules phagocytaires, les neutrophiles rentrent en apoptose et sont phagocytés à leur tour par les macrophages, processus appelé efférocytose (Fiches 6 et ses commentaires, p153). A ce stade, la réaction inflammatoire aiguë entre dans une phase décroissante qui se traduit par un arrêt de la production de cytokines pro-inflammatoires au profit de cytokines anti-inflammatoires. Ce changement induit l’arrêt de recrutement des cellules immunitaires, l’inhibition des cellules du système inné présentes sur le site lésé et l’initiation des mécanismes de réparation tissulaire.La réparation des tissus est assurée par différents types cellulaires en fonction des dégâts. En cas d’une lésion mineure, les cellules endothéliales produisent la matrice extracellulaire permettant la réparation des tissus. Pour des lésions plus graves, les fibroblastes produisent la matrice extracellulaire et les macrophages participent à l’angiogenèse (création de nouveaux vaisseaux sanguins).